雙光子熒光成像(Two-Photon Fluorescence Imaging)
雙光子熒光顯微鏡(TPM)是激光掃描顯微鏡,局部激發基于雙光子吸收的熒光團。目前,TPM以其優異的穿透性和光學(xué)切片能(néng)力,成為(wèi)活體(tǐ)完整組織或活體(tǐ)動物(wù)亞細胞分(fēn)辨率下無創觀察細胞和器官結構和功能(néng)活動的有(yǒu)力工(gōng)具(jù)。
TPM已經在各種應用(yòng)中(zhōng)得到了應用(yòng)。神經科(kē)醫(yī)生使用(yòng)TPM來監測突觸、軸突、樹突、棘、神經活動和神經網絡。在不同的刺激下,如觸覺、食物(wù)、電(diàn)和視覺模式,動物(wù)的反應行為(wèi)伴随着功能(néng)性神經尖峰和結構變化[1-5]。因此,特定的行為(wèi)與特定的神經反應有(yǒu)關。這些聯系提供了重要的信息,可(kě)能(néng)表明神經系統如何處理(lǐ)來自外部世界的信息,并激活來自單個神經系統内部的命令。TPM作(zuò)為(wèi)神經科(kē)學(xué)的一種工(gōng)具(jù),發揮着極其重要的作(zuò)用(yòng)。此外,采用(yòng)TPM觀察免疫效果。
1.雙光子吸收和雙光子顯微鏡
1929年,在哥(gē)廷根理(lǐ)論物(wù)理(lǐ)研究所,Maria Göppert-Mayer研究了兩個光子同時被一個分(fēn)子吸收的量子可(kě)能(néng)性[15]。然而,雙光子吸收的可(kě)能(néng)性極低,需要極高的峰值光強度來實現演示。直到1961年,Kaiser和Garrett在1960年5月Maiman發明激光後不久,才在實驗中(zhōng)首次實現了雙光子吸收[16]。1990年,Denk和Strickler和Webb将雙光子吸收與激光掃描共聚焦熒光顯微鏡相結合,具(jù)有(yǒu)前所未有(yǒu)的能(néng)力[17]。從那時起,配備了皮秒(miǎo)或飛秒(miǎo)脈沖、高功率激光器的雙光子顯微鏡已經成為(wèi)生物(wù)學(xué)和醫(yī)學(xué)領域三維高對比度、高分(fēn)辨率、快速成像的标準工(gōng)具(jù)。

圖1.雙光子激發和雙光子顯微鏡。(a)單光子激發示意圖和雙光子激發。(b)雙光子顯微鏡系統。(c) (a)單光子圖像熒光和雙光子熒光。(來源于文(wén)獻[18])
如圖1.a所示,一個熒光團分(fēn)子被一個光子激發到一個高能(néng)狀态。在這種狀态下停留很(hěn)短的時間後,通過非輻射弛豫,熒光團轉移到基态,并在納秒(miǎo)内發射熒光光子。由于弛豫能(néng)的損失,激發光子的能(néng)量大于發射光子;換句話說,激發光的波長(cháng)比發射光的波長(cháng)短。對于單光子激發,發射熒光的強度與激發激光的強度成線(xiàn)性正比。
如果一個光子的能(néng)量不足以将熒光團激發到激發态,則不會發生激發和發射。然而,如果兩個光子的能(néng)量足夠,則可(kě)能(néng)發生激發。為(wèi)了更容易理(lǐ)解,我們可(kě)以假設一個功率不足的光子将熒光團推到持續很(hěn)短時間的虛狀态。在此期間,如果該虛态熒光團遇到另一個功率不足的光子,并且這兩個光子的能(néng)量足以激發,則可(kě)能(néng)發生激發,如圖1.a所示。對于雙光子激發,發射熒光的強度與激發激光強度的平方成正比。不同分(fēn)子的雙光子激發概率用(yòng)橫截面表示,單位為(wèi)GM (Göppert-Mayer)或10 x 50 cm4 s/光子。例如,EGFP (Clontech)在927 nm波長(cháng)下的雙光子激發截面約等于39 x 10 x 50 cm4 s/光子。由于這種極低的概率,雙光子吸收是罕見的,很(hěn)難觀察到。為(wèi)了提高雙光子吸收,一種方法是使用(yòng)具(jù)有(yǒu)更高雙光子橫截面和适當波長(cháng)的明亮标記進行照明。另一種方法是在空間和時間上聚焦激光,形成更密集的光子通量。實際上,高na(數值孔徑)物(wù)鏡用(yòng)于緊聚焦激光,以在空間上增加光子密度。同時,脈沖激光被用(yòng)來暫時增加光子的密度。
一個典型的雙光子顯微鏡系統如圖1.b所示,由Ti:藍寶石激光器、galgal反光鏡、物(wù)鏡和光電(diàn)倍增管(PMT)組成。脈沖激光光斑被樣品平面上的反射鏡掃描,熒光被收集,然後由于其靈敏度投射到PMT上。然後,将PMT記錄的信号重新(xīn)組織成時間序列,形成圖像。例如,由于其穩定性和靈活性,将重複頻率為(wèi)80 MHz,脈沖持續時間為(wèi)~100 fs,平均功率為(wèi)50 mW的鎖模Ti:藍寶石激光器用(yòng)于雙光子顯微鏡,該激光器由532 nm的激光器泵浦,産(chǎn)生700-1300 nm的脈沖激光。掃描儀,通常是一個兩軸galvom鏡或聲光偏轉器(AOD),将激光光斑重定向到标本平面上的不同橫向位置。對于體(tǐ)成像,需要軸向掃描機制,通常使用(yòng)壓電(diàn)、電(diàn)可(kě)調透鏡(ETL)、空間光調制器(SLM)、可(kě)調聲學(xué)梯度折射率透鏡(TAG)或遠(yuǎn)程聚焦。有(yǒu)不同的掃描策略,如逐行掃描或逐目标掃描。最常用(yòng)的逐行掃描以有(yǒu)限的成像速度産(chǎn)生足夠的采樣。高速逐目标成像僅掃描先前對大腦區(qū)域掃描确定的一些固定位置,以定位單個神經元[19]。
由于雙光子熒光的稀缺性,雙光子顯微鏡中(zhōng)的檢測器必須具(jù)有(yǒu)很(hěn)高的靈敏度。pmt和雪(xuě)崩光電(diàn)二極管(apd)在低光子探測中(zhōng)得到了廣泛的應用(yòng)。PMT使用(yòng)多(duō)個外部放大器,以近1ns的短響應時間将一個電(diàn)子提升到數百萬個。TPM的一個優點是光學(xué)切片能(néng)力。如上所示,雙光子吸收是困難的,隻有(yǒu)靠近激光焦點的區(qū)域才有(yǒu)足夠的光子進行有(yǒu)效的雙光子激發,因此收集到的熒光隻來自于如圖1.c所示的焦點區(qū)域。因此,在遠(yuǎn)離焦點的區(qū)域沒有(yǒu)足夠的TPM激發,從而導緻較少的光漂白和光毒性。這種光學(xué)切片能(néng)力非常類似于在單光子共聚焦顯微鏡,但源于雙光子激發沒有(yǒu)針孔。TPM具(jù)有(yǒu)光學(xué)切片能(néng)力,在一般情況下提供高信噪比的圖像,對比度令人滿意。
TPM的另一個優點是它對樣品的滲透深度長(cháng)。事實上,不均勻的生物(wù)組織散射光,導緻退化的約束激發光子密度和成像對比度。在散射中(zhōng)占主導地位的瑞利散射與波長(cháng)成反比,TPM中(zhōng)使用(yòng)的紅外光的波長(cháng)比傳統的單光子顯微鏡(如共聚焦顯微鏡)中(zhōng)使用(yòng)的可(kě)見光的波長(cháng)長(cháng)。此外,與單光子成像相比,雙光子成像中(zhōng)波長(cháng)較長(cháng)的激發光被生物(wù)組織的主要成分(fēn)水吸收較少。這兩大特性使得TPM中(zhōng)的紅外光激發更深。這種特性對于需要深穿透深度的應用(yòng)至關重要。
因此,TPM特别适用(yòng)于活體(tǐ)和原位深部埋深、分(fēn)布較厚的組織的成像目标,如皮層下神經元的成像。此外,由于光效率的關系,光漂白和光毒性不是光子預算的主要考慮因素。但是,應考慮線(xiàn)性吸收引起的熱損傷。據報道,平均功率的安(ān)全限制為(wèi)2-5 mW/μm2,脈沖能(néng)量密度的安(ān)全限制為(wèi)0.025-0.06 nJ/μm2。
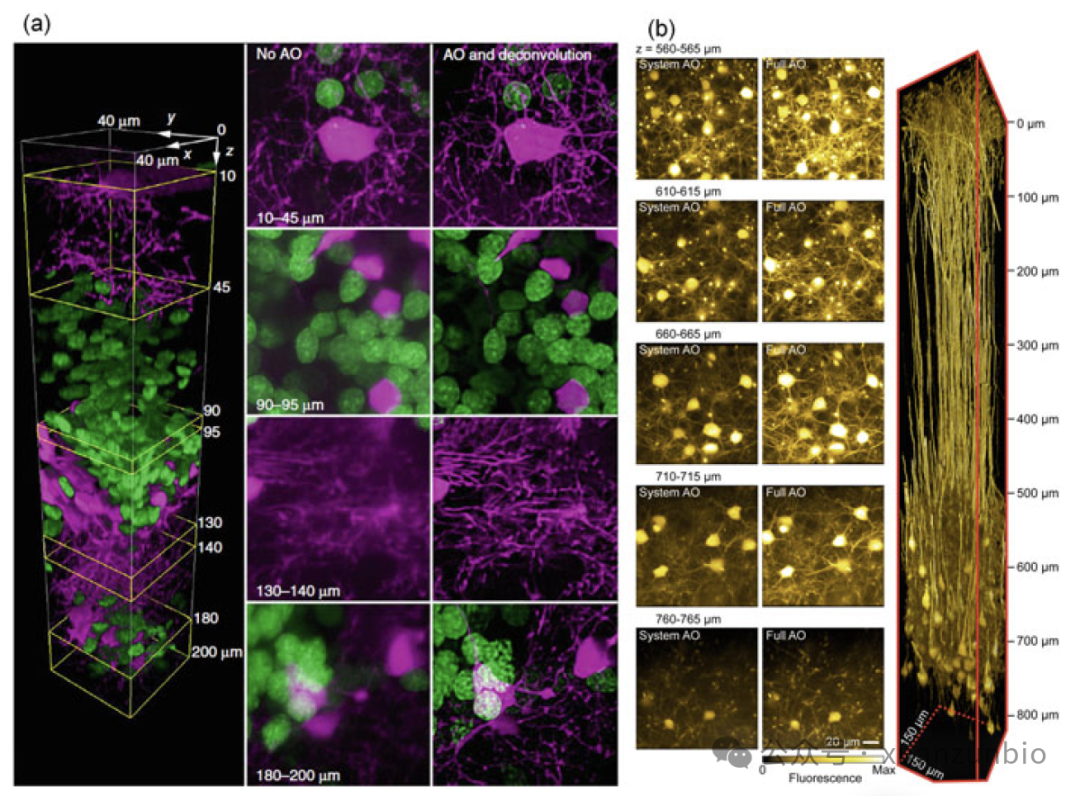

圖2.基于TPM的ao輔助共聚焦和TPM。(a)的雙色共聚焦成像少突膠質(zhì)細胞(洋紅色)和神經元核(綠色)(來源于參考文(wén)獻23)。(b) TPM三維圖像堆棧和不同深度的圖像來自于體(tǐ)積為(wèi)810μm3的體(tǐ)内神經元成像vS1皮質(zhì)與系統AO和完全AO校正。(來源于參考文(wén)獻26)
在神經科(kē)學(xué)中(zhōng),視覺刺激,例如旋轉光栅圖案,虛拟現實場景或LED信号,對于發現行為(wèi)與神經元反應之間的聯系和關系至關重要。然而,包括斑馬魚在内的大多(duō)數動物(wù)在單光子顯微鏡下都能(néng)看到光源,這就提出了一個問題,即神經元是對視覺刺激模式做出反應,還是僅僅對單光子激光激發源做出反應。相比之下,在雙光子顯微鏡下,紅外光源是不可(kě)見的,這就排除了光源幹涉的可(kě)能(néng)性。
由于存在不均勻的折射率和組織散射,激發光經常發生畸變,難以有(yǒu)效聚焦。扭曲的點擴展函數(PSF)降低了光子強度,導緻信号急劇下降,直到信号在一定深度完全淹沒在噪聲中(zhōng)。自适應光學(xué)(AO)系統通常用(yòng)于處理(lǐ)這種情況。在檢索或重建樣品誘導的波前後,通過使用(yòng)有(yǒu)源光學(xué)元件(如空間光調制器或可(kě)變形鏡)在系統中(zhōng)施加補償波前來抵消攝動[22-25]。此外,雙光子激發熒光還可(kě)以作(zuò)為(wèi)另一種成像模型的指導,如圖2.a, b所示。2018年,Janelia Research Campus的Betzig小(xiǎo)組[26]報道了一種結合點陣光片和基于tpm的AO的系統。将TPM的熒光發送到Shack-Hartmann波前傳感器重建局部區(qū)域的波前,并對激發和發射路徑進行補償,充分(fēn)挖掘晶格光片的功率。
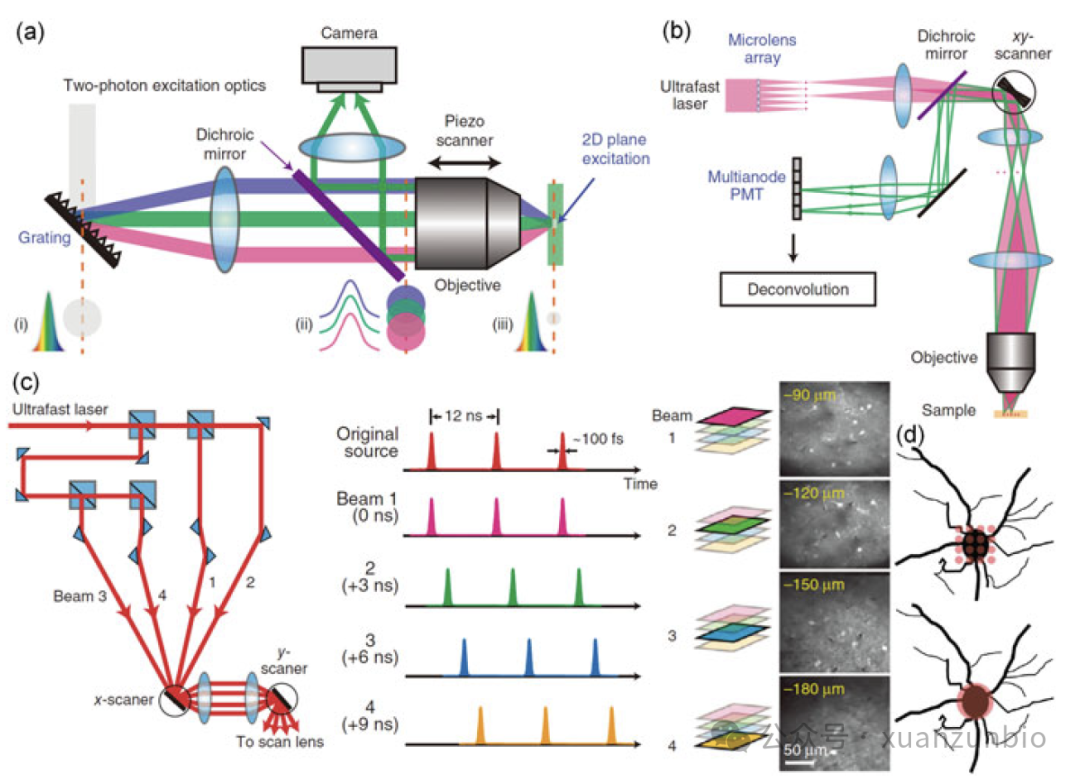

圖3.空間和時間聚焦和複雜。(a)基于雕刻PSF技(jì )術的時間聚焦示意圖,激光束撞擊光栅、物(wù)鏡的後焦平面和焦平面的時空截面剖面圖。(b)使用(yòng)微透鏡陣列的多(duō)焦點空間複合。(c)多(duō)脈沖時間複合。(d)基于衍射受限psf的采樣和基于雕刻psf的采樣的比較。(來源于參考文(wén)獻28)
2. 圖像采集速度
掃描顯微鏡的一個主要缺點是成像速度的限制。通過使用(yòng)掃描裝(zhuāng)置,例如galgal鏡,激光焦點在整個視場中(zhōng)逐點移動感興趣區(qū)域(ROI)。為(wèi)了獲得可(kě)接受的熒光強度,探測器的積分(fēn)時間應該足夠長(cháng),以接收多(duō)個熒光光子。通常,當使用(yòng)重複頻率為(wèi)80 MHz的激光源時,TPM産(chǎn)生12 MHz的有(yǒu)效像素率;換句話說,幾乎5-6個脈沖的熒光産(chǎn)生一個像素。
近幾十年來,已經開發了許多(duō)技(jì )術來解決這個問題。2005年,康奈爾大學(xué)的Chris Xu小(xiǎo)組[27]報道了空間和時間聚焦(TeFo)技(jì )術,以減少背景以獲得更好的穿透。一個光學(xué)光栅被用(yòng)來形成“彩虹”光束,平行光束按波長(cháng)線(xiàn)性位移。每個光譜分(fēn)量都是空間聚焦的,但不是很(hěn)好地重疊,這增加了光子的軸向限制。TeFo提供了一個示例來說明如何在空間和時間上調制PSF。
基于TeFo, 2016年洛克菲勒大學(xué)的Vaziri小(xiǎo)組[28]通過雕刻PSF技(jì )術演示了單脈沖每體(tǐ)素激發(圖3. d),以單細胞分(fēn)辨率實現了快速體(tǐ)積速率和大體(tǐ)積(3-6 Hz, 0.5 x 0.5 x 0.5 mm3)。利用(yòng)TeFo(雕刻型PSF ~5 x 5 x 10μm3,高斯型PSF ~5 x 5 x 70μm3)對PSF進行軸向約束和側向擴展,以激發最小(xiǎo)體(tǐ)素并解析目标,如圖3.3a所示。注意,在這種情況下,激光的重複頻率相對較低(4.1 MHz),以增加一個脈沖中(zhōng)的光子通量。通過稍微降低空間分(fēn)辨率,雕刻的PSF為(wèi)快速、大體(tǐ)積成像提供了一個概念框架。
1998年,Stefan Hell小(xiǎo)組[29]繪制了第一張用(yòng)于多(duō)光子顯微鏡的空間複用(yòng)示意圖。如圖3.b所示,利用(yòng)旋轉的微透鏡盤對激光進行空間分(fēn)離,形成多(duō)焦激勵,使成像速度提高40 - 100倍。然而,單個焦點的能(néng)量急劇下降,這對信噪比和穿透都是有(yǒu)害的。2007年,W. Amir等人[30]提出了一種時間多(duō)重多(duō)光子顯微鏡。兩個激光源由兩個相互放置的脈沖序列組成,這些脈沖序列指向樣品的不同平面,通過對記錄的信号進行解複用(yòng)得到實際分(fēn)布。這種方法提供了脈沖可(kě)以重新(xīn)排序和分(fēn)離的概念(圖3.c)。Vaziri團隊在2019年通過結合時空複用(yòng)、PSF雕刻和遠(yuǎn)程掃描技(jì )術達到了一個裏程碑[31]。一方面,利用(yòng)光栅對光按波長(cháng)進行故意分(fēn)散,形成軸向受限、橫向擴展的點擴展函數;然後,通過減少橫向采樣來提高成像速度。成功實現PSF雕刻的關鍵是使用(yòng)低重複率激光和PSF軸向限制,以确保足夠的光子強度。另一方面,将脈沖分(fēn)成多(duō)個光路以獲得不同的時間延遲,然後通過定制的鏡子沿不同的空間方向定向。時空複用(yòng)為(wèi)特定的成像需求提供了靈活的配置。通過結合雙光子/三光子顯微鏡中(zhōng)的PSF雕刻和時空複用(yòng),這種混合策略(HyMS)構建了一個集成的概念框架,以适應單細胞分(fēn)辨率的高速(16.7 Hz, 0.69 x 0.675 x 0.6 mm3,TPM)和大容量(5.1 Hz, 1 x 1 x 0.6 mm3,TPM)成像采集的需求。在這種情況下,空間分(fēn)辨率為(wèi)更高的成像速度和更大的體(tǐ)積尺度而受到損害,但仍然足以解決單個神經元。HyMS的像素采集速度接近PMT極限,像素在ROI内分(fēn)布規律。神經元在大腦皮層中(zhōng)隻占據很(hěn)小(xiǎo)的空間,一些采樣像素不提供神經元信号。因此,在神經科(kē)學(xué)中(zhōng)發展了獨特的技(jì )術。通常,三維随機存取多(duō)光子熒光顯微鏡(RAMP)[32]充分(fēn)利用(yòng)了先前的生物(wù)學(xué)知識。RAMP使用(yòng)激光聚焦光栅掃描一個神經元,然後将激光焦點重定向到另一個神經元進行掃描,如圖4.a所示。随後,在2019年,Chris Xu小(xiǎo)組提出了一種自适應激發源(AES),該激發源可(kě)以使激光焦點在空白區(qū)域被抑制,并在神經元區(qū)域出現[19],如圖4.b所示。利用(yòng)之前的全栅格掃描測量得到神經元的占用(yòng)區(qū)域及其ROI信息。與常規方案相比,激光阻斷策略大大降低了平均功率,這對于減少熱損傷的縱向神經成像至關重要。具(jù)體(tǐ)來說,每個神經元的平均光子數高出7倍,而平均功率幾乎降低了4.5倍(30 Hz, 0.7 x 0.7 mm2, 18 mW, TPM)。RAMP與AES的結合可(kě)進一步提高成像速度和效率。
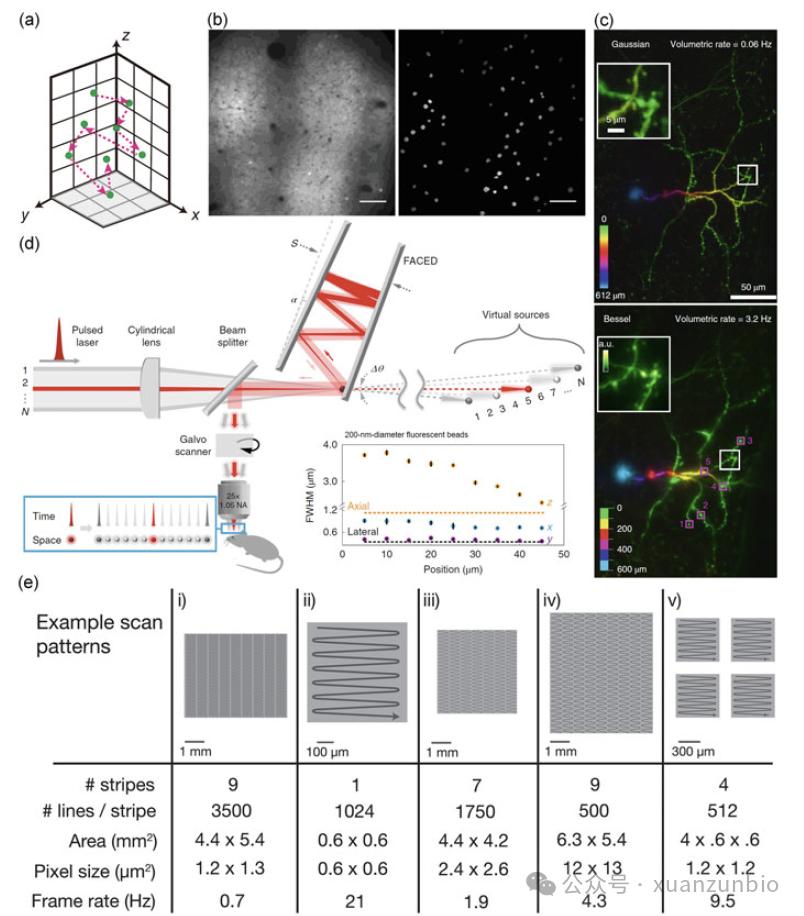

圖4.條件必選快速TPM。(a)三維随機存取多(duō)光子自定義掃描光子顯微鏡(來源于參考文(wén)獻1)。(b)清醒小(xiǎo)鼠硬腦膜下750μm神經元結構圖像的TPM比較(無自适應激勵源和有(yǒu)自适應激勵源時相同位置的TPM)。比例尺,100μm(來源于參考文(wén)獻19)。(c)清醒小(xiǎo)鼠具(jù)有(yǒu)突觸分(fēn)辨率的體(tǐ)積功能(néng)成像神經元中(zhōng)高斯和貝塞爾模塊的最大強度投影(來源于參考文(wén)獻33)。(d) faces将脈沖光片重塑為(wèi)空間分(fēn)離和時間延遲的焦點x和z方向分(fēn)辨率略有(yǒu)降低的物(wù)鏡焦平面(來源于參考文(wén)獻34)。(e)不同成像采集速度和視場的TPM成像參數優化示例。(來源于參考文(wén)獻35)
最近,香港大學(xué)的Tsia小(xiǎo)組和加州大學(xué)伯克利分(fēn)校的Ji小(xiǎo)組共同努力,報道了前所未有(yǒu)的超快TPM[34]。一個由一對幾乎平行的鏡子組成的模塊,稱為(wèi)自由空間角啁啾增強延遲(faces),用(yòng)于将一個光脈沖分(fēn)成80個脈沖,這些脈沖在時間和空間上分(fēn)離,從而實現水平圖像采樣,如圖4.d所示。然後,使用(yòng)另一個galvom反鏡進行垂直采樣,這意味着該galvom反鏡的速度決定了圖像采集速度。使用(yòng)FACED-TPM,神經元成像已觀察到高達3000 Hz (80 x 1200像素,50 x 250μm2),這足以監測一些瞬态活動。在這種情況下,像素采集率達到了PMT硬件的限制。
對于大體(tǐ)積成像,例如中(zhōng)尺度成像,成像速度遠(yuǎn)遠(yuǎn)落後于要求。最近,Ji組将貝塞爾光束模塊和介觀鏡結合起來進行稀疏标記神經元成像,避免了軸向掃描,速度提高了幾十倍[33],如圖4.c所示。貝塞爾光束模塊将高斯焦點重塑為(wèi)貝塞爾焦點,并具(jù)有(yǒu)細長(cháng)的軸向分(fēn)布。與高斯聚焦掃描策略(0.06 Hz, 307幅圖像,301x 405 x 612μm3)不同,貝塞爾焦點橫向掃描(3.2 Hz, 6幅圖像,301 x 405 x 612μm3)的熒光提供了軸向延伸的信息,而不需要實際的物(wù)理(lǐ)軸向掃描。貝塞爾光束的核心比高斯光束的核心小(xiǎo),橫向分(fēn)辨率優于高斯光束。由于貝塞爾光束軸向延長(cháng),光子密度降低,圖像信背景比(SNR)降低,穿透深度可(kě)能(néng)成為(wèi)一個問題。
3. 采集的視野體(tǐ)積
由于采用(yòng)TPM的掃描形式,可(kě)以實現體(tǐ)積視場和成像速度很(hěn)容易相互交換不同的掃描模式。如從圖4.e可(kě)以看出,大視場掃描時,激光聚焦的移動需要更多(duō)的時間。演示了針對不同應用(yòng)優化參數的TPM卡雷爾·斯沃博達在珍妮利亞研究校園報道。例如,用(yòng)TPM映像1024 x 1024像素,面積0.6 x 0.6 mm2,像素大小(xiǎo)0.6 x 0.6μm2幀率為(wèi)21,而成像由七個條紋組成,每個條紋有(yǒu)1750 x 1750像素,4.4 x 4.2 mm2面積,2.4 x 2.6μm2像素尺寸幀率為(wèi)1.9[35]。對于成像堆棧,TPM具(jù)有(yǒu)752 x 1125 x 307像素,a0.301 x 0.45 x 0.612 mm3的面積,而一個0.4 x 0.4 x 2μm3的像素大小(xiǎo)将隻有(yǒu)一個幀率為(wèi)0.06[33]。
4. 采集的深度
如上所述,TPM具(jù)有(yǒu)良好的深度滲透性。一般用(yòng)于小(xiǎo)鼠腦成像的TPM深度約為(wèi)0.6-0.7 mm,信噪比較好[19,31,33]。配備AO系統的先進TPM實現了近衍射限制。如圖2.c所示[25]。Masashi Kondo等[36]在TPM中(zhōng)使用(yòng)波長(cháng)較長(cháng)的激光源紅色指示器,對1.2 mm以内的前額皮質(zhì)和海馬進行功能(néng)性成像,其散射和吸收較少。更長(cháng)的穿透(1.2 mm)與綠色指示将需要波長(cháng)更長(cháng)的三光子激發[31,37]。
5.結論及未來展望
(1)根據不同的生物(wù)學(xué)應用(yòng),雙光子顯微鏡的空間、時間、成像深度和視場分(fēn)别有(yǒu)不同的發展方向。
(2)微型雙光子顯微鏡提出了實現自由行為(wèi)動物(wù)的高分(fēn)辨率成像的最新(xīn)前沿。
References
1. Yang W, Yuste R (2017) In vivo imaging of neural activity. Nat Methods 14(4):349–359
2. Stosiek C et al (2003) In vivo two-photon calcium imaging of neuronal networks. Proc Natl Acad Sci U S A 100(12):7319–7324
3. Svoboda K, Tank DW, Denk W (1996) Direct measurement of coupling between dendritic spines and shafts. Science 272(5262):716–719
4. Svoboda K, Yasuda R (2006) Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron 50(6):823–839
5. Ohki K et al (2005) Functional imaging with cellular resolution reveals precise microarchitecture in visual cortex. Nature 433(7026):597–603
6. Rossi B, Constantin G (2016) Live imaging of immune responses in experimental models of multiple sclerosis. Front Immunol 7:506
7. Miller MJ et al (2002) Two-photon imaging of lymphocyte motility and antigen response in intact lymph node. Science 296(5574):1869–1873
8. Schwickert TA et al (2007) In vivo imaging of germinal centres reveals a dynamic open structure. Nature 446(7131):83–87
9. Lindquist RL et al (2004) Visualizing dendritic cell networks in vivo. Nat Immunol 5(12):1243–1250
10. Yoon J-H, Jeong Y (2019) In vivo imaging for neurovascular disease research. Arch Pharm Res 42(3):263–273
11. Mulligan SJ, MacVicar BA (2004) Calcium transients in astrocyte endfeet cause cerebrovascular constrictions. Nature 431(7005):195–199
12. Imamura T, Saitou T, Kawakami R (2018) In vivo optical imaging of cancer cell function and tumor microenvironment. Cancer Sci 109(4):912–918
13. Grossmann G et al (2018) Green light for quantitative live-cell imaging in plants. J Cell Sci 131(2):jcs209270
14. Vinegoni C et al (2019) Fluorescence anisotropy imaging in drug discovery. Adv Drug Deliv Rev 151:262–288
15. Göppert M (1929) Über die Wahrscheinlichkeit des Zusammenwirkens zweier Lichtquanten in einem Elementarakt. Naturwissenschaften 17(48):932–932
16. Maiman TH (1960) Stimulated optical radiation in ruby. Nature 187(4736):493–494
17. Denk W, Strickler JH, WebbWW (1990) Two-photon laser scanning fluorescence microscopy.Science 248(4951):73–76
18. Zipfel WR, Williams RM, Webb WW (2003) Nonlinear magic: multiphoton microscopy in the biosciences. Nat Biotechnol 21(11):1368–1376
19. Li B et al (2020) An adaptive excitation source for high-speed multiphoton microscopy. Nat Methods 17(2):163–166
20. König K et al (1997) Cellular response to near-infrared femtosecond laser pulses in two-photon microscopes. Opt Lett 22(2):135–136
21. Hopt A, Neher E (2001) Highly nonlinear photodamage in two-photon fluorescence microscopy.Biophys J 80(4):2029–2036
22. Sinefeld D et al (2015) Adaptive optics in multiphoton microscopy: comparison of two, three and four photon fluorescence. Opt Express 23(24):31472–31483
23. Wang K et al (2014) Rapid adaptive optical recovery of optimal resolution over large volumes.Nat Methods 11(6):625–618
24. Wang K et al (2015) Direct wavefront sensing for high-resolution in vivo imaging in scattering tissue. Nat Commun 6:7276
25. Liu R et al (2019) Direct wavefront sensing enables functional imaging of infragranular axons and spines. Nat Methods 16(7):615
26. Liu TL et al (2018) Observing the cell in its native state: imaging subcellular dynamics in multicellular organisms. Science 360(6386):284
27. Zhu GH et al (2005) Simultaneous spatial and temporal focusing of femtosecond pulses. Opt Express 13(6):2153–2159
28. Prevedel R et al (2016) Fast volumetric calcium imaging across multiple cortical layers using sculpted light. Nat Methods 13(12):1021–1028
29. Bewersdorf J, Pick R, Hell SW (1998) Multifocal multiphoton microscopy. Opt Lett 23 (9):655–657
30. Amir W et al (2007) Simultaneous imaging of multiple focal planes using a two-photon scanning microscope. Opt Lett 32(12):1731–1733
31. Weisenburger S et al (2019) Volumetric Ca2+ imaging in the mouse brain using hybrid multiplexed sculpted light microscopy. Cell 177:1050
32. Katona G et al (2012) Fast two-photon in vivo imaging with three-dimensional random-access scanning in large tissue volumes. Nat Methods 9(2):201–208
33. Lu R et al (2020) Rapid mesoscale volumetric imaging of neural activity with synaptic resolution. Nat Methods 17(3):291–294
34. Wu JL et al (2020) Kilohertz two-photon fluorescence microscopy imaging of neural activity in vivo. Nat Methods 17:287
35. Sofroniew NJ et al (2016) A large field of view two-photon mesoscope with subcellular resolution for in vivo imaging. elife 5:e14472
36. Kondo M et al (2017) Two-photon calcium imaging of the medial prefrontal cortex and hippocampus without cortical invasion. elife 6:e26839
37. Wang TY et al (2020) Quantitative analysis of 1300-nm three-photon calcium imaging in the mouse brain. elife 9:22

END

聯系電(diàn)話:023-86185422
駱經理(lǐ):17815392366
官網:www.xuanzunbio.com
重慶市高新(xīn)區(qū)西永大道36号附4号A2092